 獨協医科大学脳神経内科
獨協医科大学脳神経内科
Department of Neurology
 獨協医科大学脳神経内科
獨協医科大学脳神経内科Department of Neurology
Column
執筆者 獨協医科大学脳神経内科 田中 秀明准教授、伊藤 雅史講師
日本には約160万人(8世帯に一人の割合で)の認知症(痴呆症)患者がいるといわれ,今後も社会の一層の高齢化にともない,増加することが予想される.
このような社会的背景のもとで,「もの忘れ外来」の役割はますます高まっていくものと考えられる.その医学的な役割としてはまず,「治る認知症」を見逃さないことである.アルツハイマー病に関しても,早期に診断をすることで,アリセプトなどの内服により可能な限り進展を抑制することが望まれる.この点については1999年Petersenらにより提唱された軽度認知機能障害(mild cognitive impairment,MCI)に注目している.
また,デイサービス等を含めた早期の対応や介護者への適切な指導によって,認知症の人の人格を傷つけることなく自信が保たれ,深刻な周辺症状(BPSD 認知症の行動心理学的症候)が生じることなく,本人家族とも落ち着いた経過をとることも可能と考えられる.
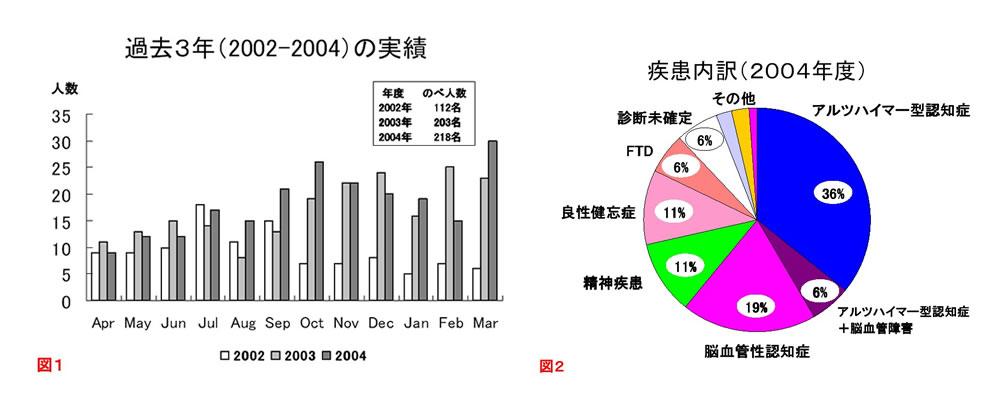
当教室では平成12年に「もの忘れ外来」を開設,平成16年度からは田中(火曜),伊藤(金曜)が担当し現在に至っている.過去3年の実績をみると着実に受診者が増加しており(図1),その内訳は図2に示す平成16年度の診療実績(新患)の通りである.現在,新たな抗認知症薬の開発(治験)への参加,J-COSMIC(後述)への参加を通じ,認知症に対するより良い治療の開発や,アルツハイマー病の早期発見につながる知見の発見のため,臨床面からのアプローチをおこなっている.
痴呆(症)の新しい名称.〔旧称に差別や偏見を助長するニュアンスがあるとして,2004 年(平成 16)に厚生労働省の検討会が改称の方針を決めた〕しかしながら,この呼称には現在各界から異論が唱えられている.(関連サイト:日本認知心理学会)
●定義
[1] 脳に器質性の異常がある(⇔内因性・心因性)
[2] 記憶や言語などの複数の認知機能が障害される
[3] 後天的障害(⇔先天異常=精神発達遅滞)
[4] 慢性的に持続(⇔意識障害・せん妄)
[5] 以上の結果,通常できていた仕事や日常生活ができなくなる
良性健忘は出来事の一部を忘れるのに対し、アルツハイマー病の場合には、出来事の全てを忘れてしまう.例えば,良性健忘では昨晩何を食べたかを忘れることはあるがヒントを与えられると思い出せる.一方,朝食を食べたかどうかもすっかり忘れてしまっていて,ヒントを与えられても思い出せない場合は認知症の記憶障害の可能性が高い.
I.中核症状
-1- 銘力,記憶力の著明な障害
-2- 見当識障害
-3- 判断力の低下
II.周辺症状
(現在では「認知症の行動心理学的症候 BPSD」と総称する)
BPSD : Behavioral and Psychological Signs and Symptoms of Dementia
【1】過活動性症状
−せん妄(夜中に騒ぐなど)
−幻覚・妄想(物を盗られた)
−不安(一人で留守番できない)・焦燥
−徘徊・多動
−異食・過食
−夜間の不眠
【2】低活動性症状
−意欲低下(やる気がなくなる,表情が乏しくなるなど)
−自発性低下
−抑うつ
−依存
−日中の傾眠
1. 同じ事を言ったり聞いたりする
2. 物の名前が出てこない
3. 置忘れやしまい忘れが目立ってきた
4. 関心ごとや興味が失われてきた
5. 日課をしなくなり,だらしなくなってきた
6. 時間や場所の感覚が不確実になってきた
7. おつりや計算の間違えが目立ってきた
8. 財布や物を盗まれたと言うことが多くなった
9. 些細なことで怒りっぽくなってきた
10. 蛇口やガス栓の締め忘れをするようになってきた
11. 迷子になることがあった
12. 服装がだらしなくなった
頭蓋内病変
I.変性疾患
[1] アルツハイマー病 [2] レビー小体型認知症 [3] 前頭側頭型認知症
[4] 進行性核上性麻痺 [5] ハンチントン舞踏病 [6] パーキンソン病など
II.脳血管障害
[1] 脳梗塞 [2] 脳出血
III.頭部外傷
[1] 慢性硬膜下血腫 ?いわゆるパンチドランカーなど
IV.正常圧水頭症
V.脳腫瘍
全身性疾患
I.内分泌障害
[1] 甲状腺機能低下症 [2] 汎下垂体機能低下症
II.代謝性認知症
[1] ウエルニッケ脳症(ビタミンB1欠乏症) [2] ペラグラ(ニコチン酸欠乏症)
[3] ビタミンB12欠乏症
III.感染症
[1] 梅毒 [2] HIV [3] クロイツフェルト・ヤコブ病
治療することによって回復可能な認知症.
[1] 正常圧水頭症 [2] 慢性硬膜下血腫 [3] 脳腫瘍 [4] うつ病(うつ状態) [5] 代謝性認知症
※うつ病(うつ状態)や上記内科疾患による認知症症状はけして少なくはない事に注意
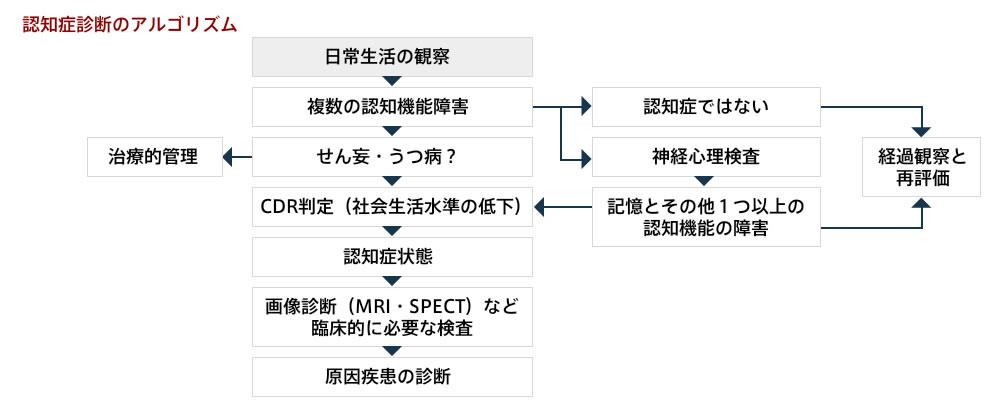
[1] まず認知症状態にあるかどうかを診断(DSM‐?)し, [2]その原因疾患の鑑別をおこなう.
*認知症の本質は社会生活活動の水準低下であり,この評価としては観察法が基本である.これにより,複数の認知機能障害(記憶・見当識・言語・視空間機能・行為・遂行機能など)が認められるかどうかを検討する.
1.面接(本人・介護者)による認知症の有無の評価;
DSM-?,Clinical dementia rating(CDR)など
2.知能評価検査;
改訂長谷川式簡易知能評価スケール (HDS-R),Mini-Mental state examination (MMSE),アルツハイマー病評価尺度(Alzheimer's Disease Assessment Scale; ADAS)など
3.画像診断;
頭部CT,MRI,SPECTなど
4.脳波検査;
一般脳波,2次元脳電図(トポグラフィ),事象関連電位(必要に応じ)など
5.血液検査;
血算,一般性化学検査,甲状腺機能検査 (TSH, F-T4, F-T3),ビタミン(B1,B12),血清梅毒,血液ガス,血中アンモニアなど
6.髄液検査(必要に応じ)
CDRは認知症の有無を評価する観察法の代表的なもので国際的に広くもちいられている.患者本人と家族に対する半構造化された認知機能に関する6項目の質問によって構成されている.質問項目は記憶,見当識,判断力と問題解決能力,社会適応,家庭状況,介護状況に関するもので,評価は正常の0から,疑い例の0.5,軽度の1,中等度の2,重症度の3までの5段階で行われ,CDR0.5は,最軽度アルツハイマー型認知症(very mild AD)と位置づけられている.
MMSE(Mini Mental State Examination)/HDS-R(改訂長谷川式簡易知能評価スケール)
認知症のスクリーニングテストとして世界的に広くもちいられているもの.
MMSEでは,見当識,記憶,計算・注意力,言語機能,構成能力についてみてゆく.5分から10分の短時間で実施可能であり,どのような機能が低下しているか,あるいは保たれているかという認知機能障害の全体像が把握できる.
一方HDS-Rは,認知症のスクリーニングテストとしてわが国で開発されたもの.MMSEと高い相関を有する.最高得点は30点で,20点以下を認知症、21点以上を非認知症としている.各重症度別の平均得点を以下に挙げる.
非認知症:24.3±3.9 軽度:19.1±5.0 中等度:15.4±3.7
やや高度:10.7±5.4 非常に高度:4.0±2.6
Hachinskiのischemic score
脳血管性認知症とアルツハイマー型認知症とを鑑別する臨床スコア.特に,脳血管性認知症を積極的に診断するためのスクリーニング法.
基本的に脳血管性認知症に多い症状を重みづけしたもので,7点以上だと脳血管性認知症,4点未満だとアルツハイマー型認知症とされる.
脳血管性認知症の特徴として発症が急激なことが多く,麻痺などの神経症候を伴いやすいことが挙げられる.これに対してアルツハイマー型認知症は変性疾患で,発症は緩徐で徐々に進行する.病理的にみられる老人斑と神経原線維変化は,まず海馬に出現して側頭葉に広がりやがて全体へと進展するが,運動領や感覚領を侵しにくいので,麻痺や感覚障害などの神経症候を呈しにくい.以上の特徴をふまえて,発症とその後の経過の違いと神経症候の有無がこのスコアに挙げられている.
ADAS(Alzheimer’s Disease Assessment Scale)
見当識、記憶、言語機能、行為・構成能力についてみるための検査.先述のMMSEよりも記憶,構成能力について重点が置かれている.「単語の再生,口頭言語能力,言語の聴覚的理解,見当識」など11項目より評価する.得点の範囲は0〜70点である(正常→重症).この検査はスクリーニング検査としてだけではなくアルツハイマー病の経過の把握・薬効の評価にも利用されている.
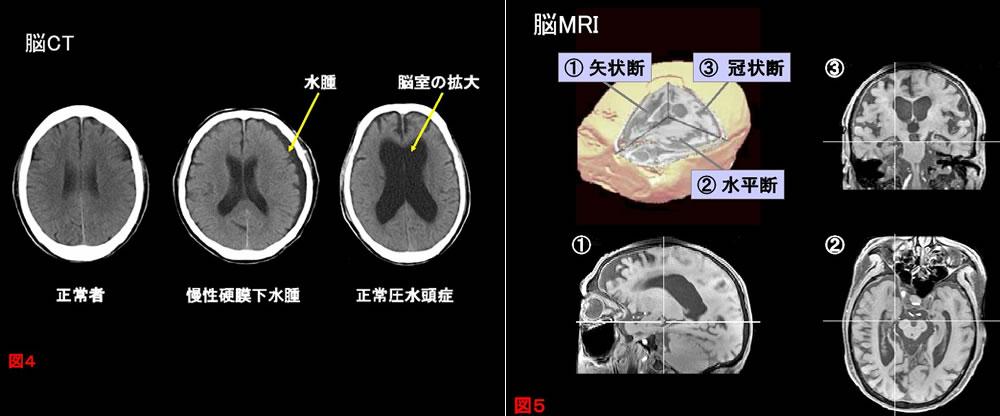
CT
一般外来で容易に施行可能で,特に治療可能な認知症のスクリーニングとしてもちいる(図4).また,撮像時間が短く長時間の静止が困難な患者や,MRIが禁忌で体内に磁性体が挿入されている患者にも施行可能である.
MRI/MRA
CTにくらべ,冠状断・矢状断など任意の撮像断を得ることができ(図5),微細な構造まで観察が可能である.また,MRAにより狭窄などの血管病変も確認できる.近年のコンピュータ技術の発達により,従来視察的におこなわれてきた海馬などの萎縮の評価がSPM(Statistical Parametric Mapping)の概念を導入して客観的定量的評価(VBM:Voxel Based Morphometry)も可能となった.
さらに,MRS(magnetic Resonance Spectroscopy)の手法により生体の化学的情報を得ることも可能となってきている.
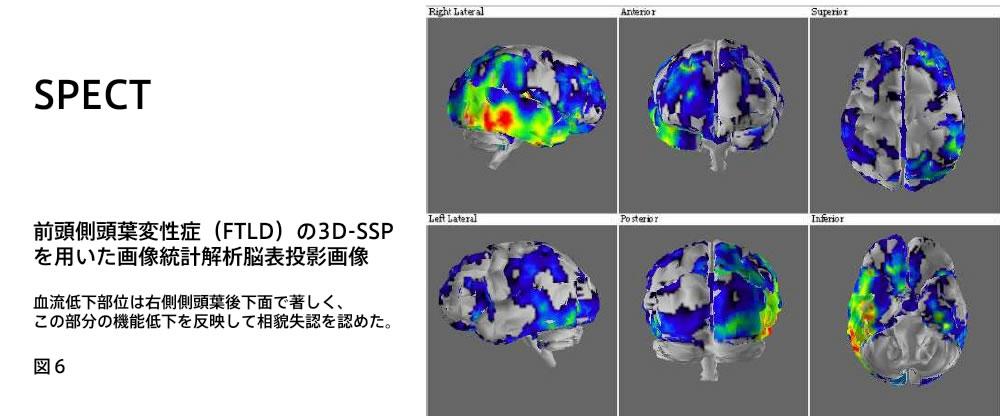
SPECT
SPECTは投与した放射性医薬品から出されるガンマ線を検出してその位置を決定する.脳血流を測定するトレーサーとして123I-IMP,99mTc-ECD,99mTc-HM PAOがもちいられている.
MRIと同様,客観的に全脳領域を検索する画像統計解析法として3D-SSP(three-dimensional stereotactic surface projection)やeZIS(easy Z-score imaging system)が日常診療の場でも普及してきている(図6).
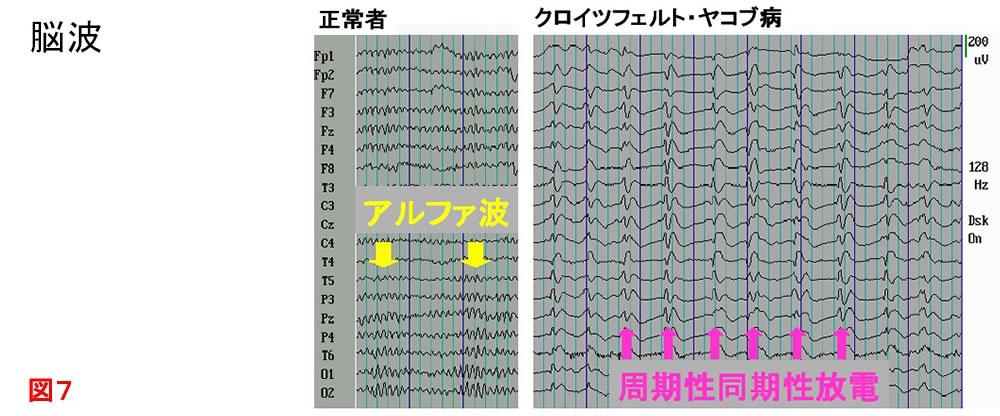
肝性脳症などの意識障害の鑑別や,周期性同期性放電(PSD:Periodic Synchronous Discharge)といった特徴的な脳波所見(図7)を呈するクロイツフェルト・ヤコブ病の診断に有用.
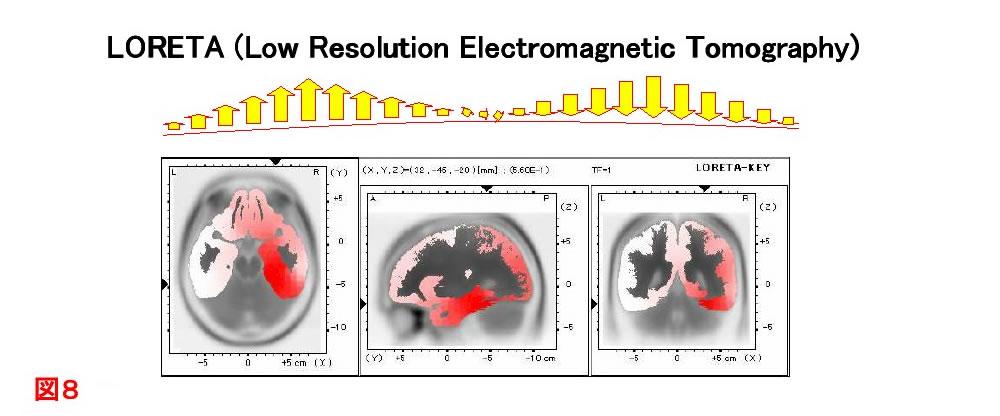
また,デジタル記録をおこなうことにより周波数解析やトポグラフィの作成,さらにLORETA(Low Resolution Electromagnetic Tomography)(図8)により皮質活動をとらえることができる.さらには薬物の効果を客観的に評価することも可能である.

認知に関連した電位で,2つの異なった音をもちいて,被験者に出現頻度の少ない刺激(標的刺激)を数えさせたりボタンを押させることにより,標的刺激の提示から約300ミリ秒後に陽性の波(P300)が記録される(図9).認知症患者ではP300が遅延するので他覚的検査として有用と考えられる.
認知症でもなく健常ともいえない群を表現するものとして,1991年Reisbergらによって提唱された.その後1999年にPetersenらによって再提示されてから再度注目され,現在この基準がもちいられることが多い.すなわち,
1)主観的な記憶低下の訴え
2)年齢に比し異常な記憶力低下(記憶検査では平均値から1.5SD以上の低下)
3)記憶以外の認知機能は正常
4)日常生活上問題なし
5)認知症ではない
の5項目を満たすものである.
MCIと診断された患者を追跡すると1年でその12%,4年ではおよそ半分がアルツハイマー病に進行したとされる.しかしながら,本人による主観的な記憶低下の主訴を診断の前提としているため,記憶低下が自覚されない例や,自覚していても年齢相応なものと納得してしまっている例など,認知症疑い例としてより注視すべき例が漏れ落ちてしまうとの問題点が指摘されている.
こうした指摘に応えて,2000年にMCIの診断基準に関するコンセンサスペーパーが提出された.それによると,
1)本人の訴えだけでなく,家族による情報を重要視
2)日常生活動作では単純なものは保持されるが,複雑なものが障害される
3)全般的認知機能尺度は年齢/教育年齢をマッチさせた場合認知症の範囲に低下しない
4)記憶や他の認知機能は年齢/教育年齢をマッチさせた正常値のカットオフ値より低下
5)認知機能障害の日常生活への影響は認知症の診断基準を満たさない
6)除外診断;抑うつ状態,意識障害,薬物中毒
などで,教育年齢を考慮していること,個人の以前の状態からの変化に着目している点などで,PetersenらのMCI基準の問題点が改善されている。
※J-COSMIC(Japan Cooperative SPECT Study on Assessment of Mild Impairment of Cognitive Function)
日本における多施設共同研究
SPECTの所見によってMCIからアルツハイマー病への進行を予測できるかどうかを検証
Petersenのamnestic MCI基準を改変して使用
1) 記憶障害の自覚,または情報提供者の証言
2) 記憶障害が年齢に比し客観的に示される.WMS-R logical memory scoreが13(65〜74歳群の75パーセンタイル値下限)以下
3) 全般的な認知機能正常.MMSEが24点以上
4) 日常生活活動は正常
5) 認知症ではない.CDRの記憶項目が0.5で,かつその他の項目がすべて0または0.5
1. 緩徐進行性に発症し進行する.
2. もの忘れと被害妄想が特徴的である.
3. 自覚はないことが多く,一見「正常」に見えることもある
4. 初期にバランス障害や転倒(パーキンソニズム)は伴わない
5. 基本的には非遺伝性
6. 脳細胞内のβアミロイド蛋白の蓄積により,脳細胞の変性が引き起こされる
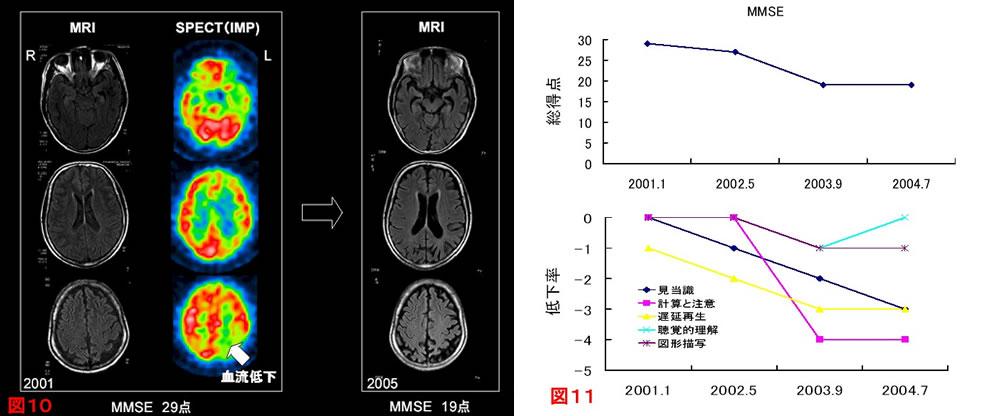
7. 画像所見(図10):海馬の萎縮+大脳皮質連合野の血流・代謝低下
8. 診断基準:NINCDS-ADRDA,DSM-?
例)62歳女性
平成13年(58歳)5月頃,物盗られ妄想が出現したため来院.仕事等の日常生活は自立していた.初診時MMSE29点(遅延再生-1)であった(図11).脳MRIではごく軽度の海馬ならびに皮質の萎縮を認めた.SPECT(IMP)では両側側頭頭頂後頭葉の血流が著明に低下していた(図10).ADと診断し塩酸ドネペジルの投与を開始した.その後も徐々に症状は進行し,平成17年(62歳)の時点でMMSE19点と低下し(図11・図12),脳MRIでは海馬ならびに皮質の萎縮が顕著となった(図10).
血管性認知症
1. 脳卒中発作後,3ヶ月以内に認知症症状が出現
2. 俗に"まだら認知症"の病状を呈する
3. 歩行障害やパーキンソニズム,尿便失禁や感情失禁などの身体機能障害を伴いやすい
4. 言葉の表出は悪いが,内面の人格は保たれている
5. 治療やリハビリによって改善が期待できる
6. 脳血管障害の危険因子(高血圧,糖尿病,高脂血症,喫煙など)を伴うことが多い
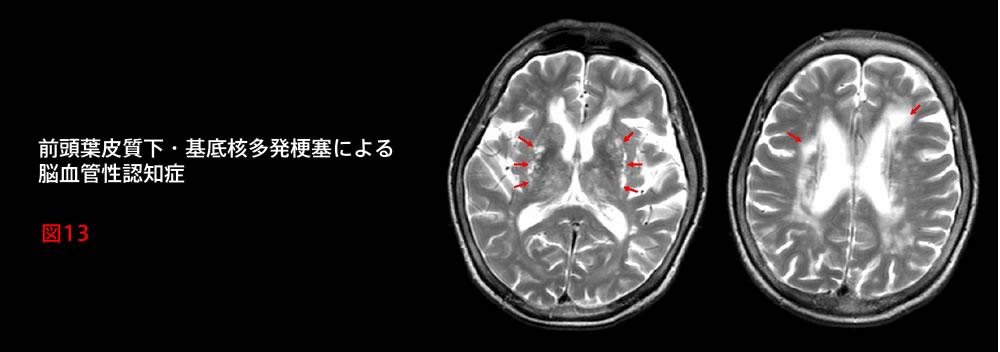
7. 画像所見(図13):脳の虚血によって引き起こされた梗塞巣が深部白質に広範描出
8. 診断基準:NINDS-AIREN(最も厳密),ADDTC,DSM-?,ICD-10
※脳MRIを施行し多発性脳梗塞を認めたからといって,安易に血管性認知症と診断してはならない.認知症+脳血管障害=脳血管性認知症ではない.
レビー小体型認知症
1. 緩徐進行性に発症し進行する.
2. まるで夢でも見ているようなリアルな幻視を伴う.
3. 症状に変動性が見られるが,徐々に悪化.
4. 初期からバランス障害や転倒(パーキンソニズム)を伴いやすい.
5. 基本的には非遺伝性.
6. 大脳皮質・扁桃核・黒質・青斑核などに多数のレビー小体が出現する.
7. 画像所見:SPECTで後頭葉の血流低下.
8. 診断基準:国際ワークショップによる診断基準.
前頭側頭葉型認知症
※新たな概念が提唱され,現在では前頭側頭葉変性症の中の1分類とされている.
1. 緩徐進行性に発症し進行する.
2. 初期に人格変化,「人が変った」と表現される.反社会的行為を認めることもある.
3. 常同行為など行動の変化がみられ,同じ道を散歩しつづけたり(ADと違い視覚性認知障害がないため,迷子にはならない),特定の食物を食べつづけたりする.
4. 初期の知的機能(記憶など)は正常.被影響性の亢進,「立ち去り行動」が特徴的.
5. 組織学的に強い萎縮を呈する前頭側頭葉にピック細胞・ピック球を認めるもの(FTLD-Pick)と,ピック球をもたず皮質表層の海綿状変化が唯一の所見であるもの(FTLD-ldh)がある.
6. 家族歴を有するものはまれ.
7. 画像所見:前頭葉・側頭葉の萎縮.
8. 診断基準:Nearyらによる臨床診断基準.
「認知症予防10か条」
(1) 塩分と動物性脂肪を控えたバランスの良い食事
(2) 深酒とタバコをやめて規則正しい生活を
(3) 適度に運動をおこない,足腰を丈夫に
(4) 転倒に気をつけ,頭部打撲を防ぐ
(5) 高血圧・高脂血症・糖尿病など生活習慣病の予防・早期発見・治療
(6) 興味と好奇心を持つ
(7) 考えをまとめて表現する習慣
(8) こまやかな気配りをした良い付き合い
(9) いつも若々しく,おしゃれ心を忘れない
(10) くよくよしないで明るい気分で生活をする
脳のトレーニング
(1) 「読み書き計算」をする
(2) 指を動かす
(3) 会話などコミュニケーションをとる
-治療-
治療方針
現状では、治療により認知症を完治することはできないので,治療より介護が中心になる.しかし,初期の段階で介入すればより改善が期待されるようになり,また,進行期にあっても治療により介護の負担軽減が可能となり,治療・介護の両面があってよりよいケアが可能となる.薬物療法は疾患によりそれぞれ異なるが,認知症症状への対処は基本的に中核症状と周辺症状(BPSD)に分けて薬剤を選択する.
薬物療法+非薬物療法+介護者・家族の認知症への理解と対応が重要
●薬物療法
アルツハイマー病
中核症状に対しては軽度から中等度の段階でコリンエステラーゼ阻害薬である塩酸ドネペジル(アリセプト®)が用いられる.これは,アルツハイマー病で減少している脳内の伝達物質であるアセチルコリンの分解酵素であるアセチルコリンエステラーゼを阻害することで,アセチルコリンの脳内の量を増やし症状を緩和・進行を抑制する.欧米では同様の薬剤としてリバスチグミン(エクセロン®),ガランタミン(レミニール®),異なるタイプのものとしてメマンチン(ナメンダ®)が市販されており,現在わが国でも治験中である.後者は中等度〜重度のアルツハイマー病に有効とされている.
その他,有効性が期待されているものとして非ステロイド系抗炎症薬(NSAIDs),スタチンによるコレステロール制御などがあり,本質的な治療として期待されているのがβ・γセクレターゼ阻害薬,Aβワクチン療法などがある.
一方,周辺症状(BPSD)に対しては,その症状に応じて抗精神病薬,抗けいれん薬,抗うつ薬などさまざまな薬がもちいられる.暴力・攻撃性などの沈静に対してはリスペリドン(リスパダール®),拒食・拒絶・拒否などにはクエチアピン(セロクエル®),オランザピン(ジプレキサ®),易怒・不機嫌などには主にチアプリド(グラマリール®)をもちいる.幻覚・妄想・せん妄にはハロペリドール(セレネース®),チアプリド(グラマリール®),スルピリド(ドグマチール®)が主に使われ,逆に自発性の低下には塩酸アマンタジン(シンメトレル®)などがもちいられる.注意点として,基本的に高齢者に対して使うため,通常の使用量の1/2〜1/3の量から開始する.
血管性認知症
進行の予防は基本的に脳血管障害の再発予防である.すなわち,高血圧・糖尿病・高脂血症などの危険因子の除去,ならびに,抗血小板剤(チクロピジン,アスピリンなど)の投与.
血管性認知症の中核症状に有効なエビデンスを有する明らかな薬剤は現在のところないが,アルツハイマー病同様アセチルコリン濃度の低下がみられることから,塩酸ドネペジル(アリセプト®)やガランタミン(レミニール®)の有効性を示唆する報告がなされている.また,自発性の低下や情緒障害に対してニセルゴリン(サアミオン®)が,抑うつに対しては選択的セロトニン再取り込み阻害薬が,抑うつに伴なう不安・焦燥感に対しては筋弛緩作用が少なく半減期の短いベンゾジアゼピン系抗不安薬が,自発性低下や意欲低下に塩酸アマンタジン(シンメトレル®)などがもちいられる.幻覚・妄想・せん妄にはアルツハイマー病と同様,ハロペリドール(セレネース®),チアプリド(グラマリール®),スルピリド(ドグマチール®)などがもちいられる.
レビー小体型認知症
アルツハイマー病よりコリンエステラーゼ阻害薬が効果的であるというデータが多く,中核症状のみならず周辺症状(BPSD)にも効果があるとされる.レビー小体型認知症はパーキンソン症状で始まる例も少なくなく,この場合早期にはLドーパを中心とする抗パーキンソン病薬が効果的である.また,しばしば抗精神病薬に過敏に反応し,症状が悪化することが知られており(neuroleptic sensitivity),周辺症状(BPSD)に従来の定型抗精神病薬の使用は避ける.リスペリドン(リスパダール®),クエチアピン(セロクエル®),オランザピン(ジプレキサ®)などの非定型抗精神病薬の少量投与が薦められるが,現在のところ一定の見解はない.
非薬物療法
−デイサービスを中心とした脳活性化訓練
−運動療法
−歩行訓練などの理学療法
−入浴を含む物理療法
−生活動作訓練
−右脳刺激を目的とした,カラオケ,陶芸,手芸,書道,詩吟,茶道
●介護の基本原則
(1) 不安を取り,楽しい気分になるように
(2) 言ったりしたりしたことを受け入れ,否定しない
(3) ゆっくり,本人のペースに合わせる
(4) できることを探し,できることはしてもらう
(5) 分かりやすい環境を作る
(6) 視野に入って,分かりやすい言葉で簡潔に話す
●周辺症状(BPSD)への対応
(1) 妄 想・・・・感情を共有して味方になってあげる.けして責めない.
(2) 幻 覚・・・・話をよく聞き,否定したり説得したりしない.安心感を与える.
(3) 見当識障害・・季節や月日が分かり易いように目につく所に日めくりを置く
(4) 人物誤認・・・否定しないでまず受け入れる.しばらく話を合わせる.いったん姿を隠す.
(5) 徘 徊・・・・一緒に出かけて,気が晴れたら自宅に帰る.ブザーをつけたり,ネットワークをつくる.衣服や靴に名札をつける.
(6) 性格変化・・・冷静になって対処する.うまくいかないときは家族以外の助けを借りる.
(7) 問題行動・・・厳しくは叱らない.スキンシップや話しかける回数を増やす.
(8) 夜間せん妄・・落ち着くまでそばに居てあげる.静かで落ち着く部屋で様子を見る.規則正しい生活をさせる.健康状態のチェックを忘れずに.
●相談窓口
(1) 保健所・保健センター
(2) 在宅介護支援センター
(3) 介護支えあい相談(厚生労働省助成事業)
(4) 高齢者総合相談センター
(5) (社)呆け老人を抱える家族の会
●在宅で受けられるサービス
(1) 訪問介護(ホームヘルプサービス)
(2) 訪問診療
(3) 訪問看護
(4) 通所介護(デイサービス)
(5) 短期入所生活介護(ショートステイ)
●成年後見制度
認知症が進むと判断力が低下し,自分自身で生活や財産などを管理することが難しくなり,時には高額な商品の購入や契約など犯罪に結びつく可能性も出てくる.このような方を保護し支援するため,平成12年4月にこの制度が誕生した.
大きく分けると法定後見制度と任意後見制度の2つで,前者は「後見」「補佐」「補助」の3つに分かれており,判断能力の程度など本人の事情により制度を選べるようになっている.手続きは,申立て人が家庭裁判所に申立書を提出しておこなうが,必要に応じて主治医(または専門医)による診断書が必要となる.後者は,本人の意思能力が保たれているうちに,予め特定の後見人を選び,自分の判断能力が不十分な状態となったときに生活・療養看護・財産管理などに関する事務の全部あるいは一部を任せる契約をする制度.
●参考図書
(一般)
1. 100歳の美しい脳.デヴィッド・スノウドン著 藤井留美訳 DHC
2. アルツハイマー-その生涯とアルツハイマー病発見の軌跡.コンラート・マウラー,ウルリケ・マウラー共著 新井公人監訳 保健同人社
3. インターネットで痴呆外来を 笠間睦著 つげ書房新社
(専門)
1.<神経心理学コレクション>痴呆の臨床-CDR判定用ワークシート解説- 目黒謙一著 医学書院
2.見て診て学ぶ痴呆の画像診断 松田博史,朝田隆 編集 永井書店
3.認知症ケアにおける基礎疾患と薬-チームアプローチが創るQOL 播本高志,出野平恵著 中央法規
●リンク集
1. 認知症(痴呆症)を知るホームページ
2. 公益社団法人 認知症の人と家族の会
3. LORETA(The KEY Institute for Brain-Mind Research)
●[問い合わせ先]
獨協医科大学 脳神経内科外来
栃木県下都賀郡壬生町北小林880番地 外来受付電話;0282-87-2198(直通)
もの忘れ外来;水曜日・木曜日(全予約制)
※ かかりつけ医のある方は,必ず電話・Fax予約の上,紹介状をご持参ください
[文責:田中 秀明]